
4月第一周,业界目光聚焦在了全球CAR-T领域一个里程碑时刻。
港股上市公司金斯瑞生物科技旗下传奇生物迎来重大突破,融中了解到,其自主研发的细胞治疗产品——西达基奥仑赛(CARVYKTI®),成功获得美国食品药品监督管理局(FDA)用于治疗复发或难治性多发性骨髓瘤二线患者批准。全球首款且唯一被FDA批准用于多发性骨髓瘤二线治疗的B细胞成熟抗原(BCMA)靶向疗法由此诞生。
作为传奇生物的母公司及最大股东方,金斯瑞生物多年来持续投入与始终注重研发的战略,得到了巨大回报。
金斯瑞生物科技股份有限公司成立于2002年,如今已经成为全球领先的生命科学研发与生产服务商。植根于坚实的DNA合成技术,金斯瑞现已建立四大主要业务单元,包括生命科学服务及产品业务单元、生物制剂合约开发及生产(CDMO)业务单元、工业合成产品业务单元、综合性全球细胞疗法公司。
成立以来,金斯瑞携手合作伙伴,加速推动科学发现与疗法突破,业务运营范围已覆盖全球100多个国家和地区,为20余万客户提供优质服务和产品。金斯瑞在全球现有6900余名员工。截至2023年12月31日,已有88,700余篇经国际同业审阅的学术期刊文献引述了金斯瑞的服务及产品。秉承“用生物技术使人和自然更健康”的企业使命,金斯瑞致力于成为全球“最受信赖的生物科技公司”。
融中获悉,金斯瑞控股子公司传奇生物成立于2014年,是一家集肿瘤免疫细胞疗法研发、临床、生产及商业化开发于一体的跨国生物制药公司,位列全球免疫细胞疗法领域第一方阵,全球员工总数已逾1500人。
01
聚焦Best-in-Class药物发展潜力
目前,全球已有10款CAR-T产品获批上市,其中美国FDA批准了6款,中国国家药品监督管理局(NMPA)批准了4款。
自2022年获FDA批准上市以来,西达基奥仑赛的商业化历程令人印象深刻。其在早期增长曲线中展现出显著优势,销售业绩一路“高歌猛进”。金斯瑞最新发布的年报显示,2023年全年,西达基奥仑赛销售额突破5亿美元大关,不仅确立了其成为上市后增长最快的CAR-T疗法地位,还充分展现出其优异的市场竞争力和持续增长的潜力。结合临床数据与商业化表现,西达基奥仑赛展现出了Best-in-Class药物的发展潜力。
CAR-T疗法(部分)全球销售按季度统计表
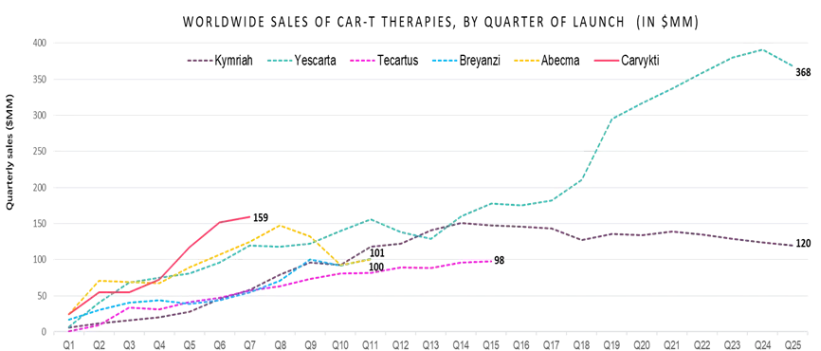
图源:传奇生物官网
细看实际销售情况,传奇生物的商业化能力正在成为CAR-T行业的新标杆,市场渗透率加速提升。尤其是,西达基奥仑赛上市后前七个季度的销售表现超越了其他CAR-T上市产品,累计治疗患者数量超过2500名。当前,该产品的市场接纳速度和销售增长速率均为同类产品中的佼佼者,这使得西达基奥仑赛被广泛看好,有望在未来问鼎CAR-T领域的“药王”地位。
FDA对西达基奥仑赛的批准,基于CARTITUDE-4研究的积极结果。该研究表明,与泊马度胺、硼替佐米和地塞米松(PVd)或雷妥尤单抗、泊马度胺和地塞米松(DPd)这两种标准治疗方案相比,CARVYKTI®能显著改善既往接受过一至三线治疗的复发且来那度胺耐药的多发性骨髓瘤成人患者的无进展生存期(PFS),该结果具有统计学和临床意义。此次批准是在FDA肿瘤药物咨询委员会(ODAC)一致推荐(11比0)支持西达基奥仑赛用于前线治疗之后作出的。
传奇生物CEO黄颖表示:“西达基奥仑赛适应症的扩大有望改变多发性骨髓瘤的治疗格局,为医生和患者提供了一种可在早期治疗方案中使用的个性化免疫疗法。多发性骨髓瘤是一种无法治愈且不断进展的血液肿瘤,会导致患者复发并产生耐药,因此亟需创新的治疗选择。我们致力于改善血液肿瘤患者的生活质量,并持续努力开发出能够为患者带来治愈希望的细胞疗法。”
而斯坦福大学医学院血液和骨髓移植及细胞疗法医学助理教授、医学博士 Surbhi Sidana 则评论道:"CARTITUDE-4研究结果表明,对于既往经历一到三次治疗后复发的患者,输注西达基奥仑赛比持续用标准疗法治疗具有显著的临床获益。此次FDA批准扩大西达基奥仑赛的适应症范围,将会使更多患者在治疗过程中更早获得这种创新疗法。”
02
前线获批提升母公司业绩预期
西达基奥仑赛获FDA批准用于二线治疗,对于提升母公司金斯瑞的财务表现及业绩展望具有显著利好作用。回顾西达基奥仑赛的研发过程,不难看出,传奇生物充分依托了金斯瑞在生命科学领域长达20多年的技术积淀。这一稳固的基础,为传奇生物在CAR-T疗法领域的“一鸣惊人”提供了有力的支撑。
金斯瑞集团CFO魏师牛表示,自2022年西达基奥仑赛在美获批上市以来,其全球化商业化进程可谓势如破竹,展现出优异的市场接纳度和强劲的销售势头,提振了传奇生物乃至母公司金斯瑞的整体财务表现,并逐渐成为驱动集团业绩稳健增长、增强市场竞争力和实现可持续发展的重要引擎之一,凸显了公司长期投入研发、聚焦创新药物的战略选择的前瞻性。随着产品渗透率的不断攀升、市场覆盖范围的持续扩大以及潜在适应症的拓展,西达基奥仑赛将持续为集团创造丰厚回报。此外,西达基奥仑赛在中国的商业化之路也已步入快车道。目前,该产品新药上市申请已获得中国国家药品监督管理局(NMPA)受理并被纳入优先审评。一旦获批,其国内市场潜力也将得到释放。
根据官方公布的数据,金斯瑞在过去五年保持了年化复合增长率超过30%的良好势头,全球化经营稳步推进,现金流稳定,为公司长远发展构筑了坚实的基石。作为金斯瑞旗下四大业务板块之一,细胞疗法业务收入子公司传奇生物2023年外部收入同比增长144.2%,继续保持高位增长,无疑进一步提振了外界对金斯瑞实现更强劲发展的信心。
行业观察者普遍看好西达基奥仑赛二线获批后的市场潜力,美国媒体分析指出,相较于同期获批的同类多发性骨髓瘤治疗产,西达基奥仑赛的前线适应症获批“更具优势”。Jefferies分析师认为,更早一线的获批对于西达基奥仑赛赢得更大多发性骨髓瘤适应症市场具有重大意义,这能让该产品在多发性骨髓瘤治疗中获得“绝无仅有”的OS优势,从而赢得大部分CAR-T市场,预期在2024年下半年迎来更为强劲的销售势头。
据TD Cowen分析师预测,随着产品前线适应症批准和品牌影响力的扩大,该疗法今年有望达到9.5亿美元的新高度。西达基奥仑赛的二线治疗获批不仅是传奇生物的,更是整个CAR-T领域的一个重大里程碑,因为它将大大增加有资格接受CAR-T治疗的患者数量,并进一步确立CAR-T作为一种有效的早期治疗手段的地位。
03
持续提升产能满足市场需求
根据美国媒体援引强生发布的报告,约有2.1万名四线及以上阶段的多发性骨髓瘤患者和11.8万名二线及三线患者符合西达基奥仑赛的治疗条件。扩展标签适用于既往至少接受过一线治疗,包括一种蛋白酶体抑制剂(PI)和一种免疫调节剂(IMiD)且对来那度胺耐药的患者。近六倍的潜在患者基数扩张,使得西达基奥仑赛有机会为更多亟待治疗的患者提供治疗方案的同时,能够拓展更大的市场份额。
面对不断增长的市场需求,传奇生物正持续优化和提升产能,以确保西达基奥仑赛的稳定供应。据了解,传奇生物位于比利时根特的新厂房已经开始临床生产,公司的细胞处理能力较2023年初实现了翻倍增长。在产能建设方面,公司设定的明确目标是在2025年年底支持西达基奥仑赛每年约10,000人份的产能。此举被认为将大幅提升西达基奥仑赛在全球CAR-T疗法市场的竞争力,从而为更多患者提供及时有效的治疗。此外,传奇生物3月27日发布公告,宣布与CMO合作伙伴诺华就BCMA CAR-T产品订立新的生产及供应服务协议,该协议将双方的合作范围由临床阶段的生产扩大到了商业化供应。交银国际的前瞻性分析认为,西达基奥仑赛有极大可能在全球范围成为一款重磅药物,其销售峰值将达到至少50亿美元,结合目前西达基奥仑赛全球定价与产能扩张速度,此销售峰值在不久的将来即可达成。
传奇生物全球生产与供应高级副总裁Birk Vanderweeën表示:“此次扩大适应症的批准证实了对西达基奥仑赛日益增长的需求,意味着更多患者将获得这一改变生活的个性化疗法。为了确保能够满足对定制化疗法持续增长的需求,我们的全球制造团队和合作伙伴已经扩大了产能,并专注于进一步扩大运营规模,以确保患者能够获得西达基奥仑赛。”
几乎与此同时,传奇公司的另一个BCMA靶点的自体细胞治疗项目、针对胃癌的靶向药LB1908研究以及治疗多发性骨髓瘤的LB2103项目等,均取得了不同程度的积极进展,并已与诺华达成深度合作。多元化的项目推进不仅丰富了传奇生物的产品管线,也为公司在细胞治疗领域的长远发展创造着更多可能。
此前,西达基奥仑赛便在业界获得了广泛的认可和关注。今年2月,欧洲药品管理局(EMA)的人用药品委员会(CHMP)已建议批准扩大西达基奥仑赛的适应症范围,以纳入既往至少接受过一线治疗(包括一种免疫调节剂和一种蛋白酶体抑制剂)的复发和难治性多发性骨髓瘤成人患者,这些患者在最后一线治疗中出现疾病进展且对来那度胺耐药。该产品由此成为首个在复发或难治性多发性骨髓瘤患者二线治疗中获得欧洲药品管理局CHMP积极意见的CAR-T疗法。
西达基奥仑赛二线治疗获批,对传奇生物及其母公司金斯瑞的财务表现带来了显著提振效应。面对广阔的市场前景与强劲的商业化势头,这一关键性进展不仅是公司在细胞疗法领域的阶段性胜利,更是其开启新一轮高速增长周期、实现长期价值提升的重要起点。面对未来,业界有理由相信,随着西达基奥仑赛在全球范围内销售的持续推进以及研发管线的深度布局,传奇生物与金斯瑞财务成绩单将会愈加亮眼,并将诠释创新生物科技如何在驱动商业成功的同时,为全球患者带来更大的治愈希望。
目前通过与杨森的合作,首款产品CARVYKTI®(西达基奥仑赛,cilta-cel)于2022年获得美国食品药品监督管理局(FDA)、日本厚生劳动省(MHLW)批准上市,并获得欧盟委员会(EC)附条件上市许可,有望解决多发性骨髓瘤治疗的世界级难题。2022年底,国家药品监督管理局正式受理西达基奥仑赛的新药上市申请(NDA),并于2023年1月纳入优先审评程序。2024年4月5日,美国FDA批准CARVYKTI®用于治疗复发或难治性多发性骨髓瘤(RRMM)患者,这些患者既往至少接受过一线治疗,包括一种蛋白酶体抑制剂(PI)和一种免疫调节剂(IMiD)且对来那度胺耐药。此外,公司还有多款在研细胞疗法,用于血液瘤、实体瘤及其它疑难疾病的治疗。
可以想见,未来,伴随着业务持续精进,将进一步巩固金斯瑞在全球生物医药创新链中的地位。

